Bimekizumab für Plaque-Psoriasis-Behandlung zugelassen
-
 ©Pixabay_Miller_Eszter
©Pixabay_Miller_Eszter
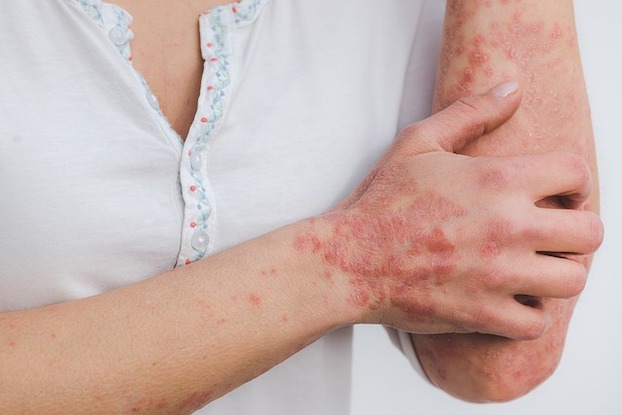
Die US-amerikanische Zulassungsbehörde für Arzneimittel (Food and Drug Administration (FDA)) hat BIMZELX® (Bimekizumab-bkzx) für die Behandlung von mittelschwerer bis schwerer Plaque-Psoriasis für all jene Erwachsenen zugelassen, die für eine systemische Therapie oder Phototherapie in Frage kommen. Somit ist Bimekizumab ist die erste und einzige zugelassene Psoriasis-Behandlung, die selektiv zwei wichtige Zytokine hemmt, die Entzündungsprozesse steuern – Interleukin 17A (IL-17A) und Interleukin 17F (IL-17F).
Die Zulassung von Bimekizumab stützt sich auf Daten aus drei multizentrischen, randomisierten, placebo- und/oder vergleichskontrollierten Phase-3-Studien (BE READY, BE VIVID und BE SURE), in denen die Wirksamkeit und Verträglichkeit von Bimekizumab bei 480 Erwachsenen mit mittelschwerer bis schwerer Plaque-Psoriasis untersucht wurde.
“Die heutige FDA-Zulassung für BIMZELX® ist ein aufregender Meilenstein, der unser Engagement für die kontinuierliche Verbesserung des Behandlungsstandards bei Plaque-Psoriasis und für die Erhöhung der Erwartungen an die Behandlung widerspiegelt. Wir wissen, dass Menschen mit Schuppenflechte Wert auf eine vollständige Erscheinungsfreiheit der Haut legen, und in unseren Phase-3-Studien erreichten 85-91% der mit Bimekizumab behandelten Patient:innen in Woche 16 eine erscheinungsfreie oder fast erscheinungsfreie Haut, wobei 59-68% das Ziel der vollständigen Erscheinungsfreiheit der Haut erreichten”, sagte Emmanuel Caeymaex, Executive Vice President, Immunology Solutions und Head of U.S., UCB. “Nachdem Bimekizumab nun für Psoriasis zugelassen ist, werden wir zügig Anträge für weitere Indikationen in den USA einreichen.”
“Wir haben mit Spannung erwartet, dass Bimekizumab, der erste IL-17A- und IL-17F-Inhibitor, in den USA für die Behandlung von Erwachsenen mit mittelschwerer bis schwerer Plaque-Psoriasis zugelassen wird. In Phase-3/3b-Studien erzielte Bimekizumab im Vergleich zu Placebo und drei bestehenden Biologika für Psoriasis in Woche 16 eine überlegene Erscheinungsfreiheit der Haut, wobei das Ansprechen schnell erfolgte und bis zu einem Jahr anhielt. Die Langzeitdaten haben auch gezeigt, dass die Mehrheit der Patient:innen über drei Jahre hinweg ein hohes Maß an klinischem Ansprechen beibehalten hat”, sagte Dr. Mark Lebwohl, Prüfarzt für Bimekizumab.
Psoriasis betrifft Millionen Erwachsene und wirkt sich nicht nur auf die Haut selbst aus. Neben den bekannten Hautsymptomen wie Juckreiz und Schuppenbildung kann die Schuppenflechte für die Patient:innen und ihre Familien eine Belastung darstellen, die sich auf die Arbeit, die Beziehungen und das Privatleben auswirkt.
Die von der FDA empfohlene Dosierung von Bimekizumab (erhältlich als Autoinjektor und als Fertigspritze) für Psoriasis-Patient:innen beträgt 320 mg (verabreicht als zwei subkutane Injektionen zu je 160 mg) in den Wochen 0, 4, 8, 12 und 16 und danach alle 8 Wochen. Bimekizumab kann von medizinischem Fachpersonal verabreicht werden, oder Patient:innen können es sich nach entsprechender Schulung selbst injizieren. UCB rechnet damit, ass Bimekizumab in den USA in etwa einem Monat verfügbar ist. Man hofft, dass die neuen Behandlungen für viele Menschen dazu beitragen kann, die körperliche und emotionale Belastung durch Psoriasis zu lindern.
Schlagwörter
Plaque Psoriasis
Hautausschläge
Dermatologie
