Rivaroxaban (Xarelto®) erhält FDA-Zulassung
-
 ©SvL_Foto von Studien-PPP
©SvL_Foto von Studien-PPP
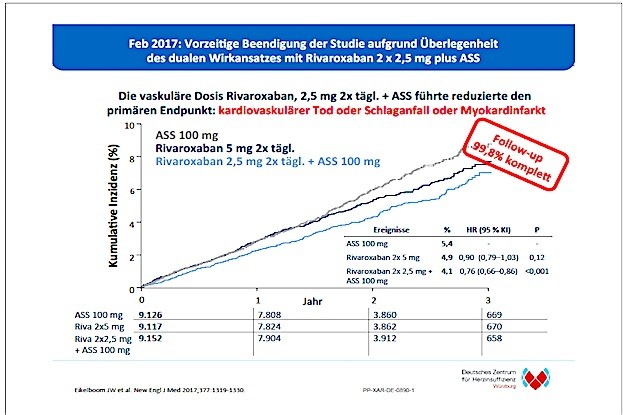
Die erwartete Zulassung der US-amerikanischen Gesundheitsbehörde FDA (Food and Drug Administration) für die Rivaroxaban-Gabe (Xarelto®) von 2,5 mg zweimal täglich in Kombination mit niedrig dosierter Acetylsalicylsäure (ASS) einmal täglich zur Reduzierung des Risikos für schwere kardiovaskuläre Ereignisse wie kardiovaskuläre Todesfälle, Herzinfarkte oder Schlaganfälle bei Patienten mit chronischer koronarer Herzerkrankung (KHK)** oder peripherer arterieller Verschlusserkrankung** (pAVK1) ist nunmehr erfolgt. Sie basiert auf den Ergebnissen der klinischen COMPASS-Studie, welche eine deutliche Risikosenkung bei Schlaganfällen, kardiovaskulären Todesfällen und Herzinfarkten bei Patienten mit KHK oder pAVK dank Rivaroxaban in der vaskulären Dosierung gezeigt hat. Damit folgt die FDA der bereits erteilten Zulassung durch die Europäische Kommission sowie der Zulassung in Kanada für diese Patientengruppe.
Xarelto® ist das einzige nicht-Vitamin-K-abhängige orale Antikoagulanz (NOAK), das in Kombination mit ASS für diese Patientengruppe zugelassen ist. Rivaroxaban plus ASS verbessert die Prophylaxe bei Patienten mit koronarer Herzerkrankung oder symptomatischer peripherer arterieller Verschlusserkrankung und hohem Ischämierisiko. Auch die Subanalysen der COMPASS-Studie untermauern den besonderen Nutzen dieses Regimes bei Hochrisikopatienten.
-
pAVK ist ein atherosklerotischer Prozess, der eine Stenose und Okkasion der nicht-zerebralen und nicht-koronaren Arterien verursacht ↩
